王四宝研究组揭示杀虫真菌侵染结构附着胞分化形成的表观遗传机制及调控通路
2020年3月26日,中国科学院分子植物科学卓越创新中心(植物生理生态研究所)、中国科学院昆虫发育与进化生物学重点实验室王四宝研究组与中国科学院上海营养与健康研究所魏刚研究组合作在国际学术期刊《科学进展》(Science Advances)上在线发表了题为“Coordinated regulation of infection-related morphogenesis by the KMT2-Cre1-Hyd4 regulatory pathway to facilitate fungal infection”的研究论文。该研究揭示了杀虫真菌通过表观遗传KMT2-Cre1-Hyd4通路调控真菌侵染结构—附着胞的发育分化和杀蚊毒力的分子机制。
蚊虫是疟疾、登革热等多种疾病的传播媒介。蚊虫控制是阻断蚊媒传染病的重要措施。有别于细菌和病毒等杀虫微生物需要通过消化道侵染昆虫,杀虫真菌以穿透体壁的入侵方式感染昆虫,能够更高效地杀死抗药性蚊虫,显著降低蚊媒疾病的传播,具有环境友好、持续控制、不易产生抗性的特点,因而在蚊虫生物防治和阻断疾病传播上具有巨大的优势,被认为是最有潜力的下一代生物杀蚊剂之一。在入侵寄主体壁的过程中,杀虫真菌产生一种重要的特殊侵染结构——附着胞,附着胞通过分化成侵染钉以及分泌一系列降解昆虫体壁的胞外酶等方式来穿透体壁。因此,附着胞的分化形成对于真菌成功侵染寄主蚊虫至关重要。然而,人们对附着胞分化形成的调控机制知之甚少。
本研究基于前期真菌与蚊虫互作过程中的基因表达谱分析(Science China Life Sciences, 2017),鉴定到一个在绿僵菌早期侵染蚊虫体壁时特异上调表达的表观遗传调控因子——组蛋白赖氨酸甲基转移酶基因kmt2。研究表明KMT2催化组蛋白H3第4位赖氨酸甲基化(H3K4me3)修饰,在真菌侵染蚊虫体壁阶段发挥重要的调控作用。敲除kmt2基因显著减少真菌附着胞的形成,并显著降低杀蚊毒力。转录组测序(RNA-seq)研究发现,经昆虫体壁诱导后,依赖于MrKMT2的差异表达基因主要参与脂类、碳水化合物的代谢和转运。利用染色质免疫共沉淀结合二代测序(ChIP-seq)技术,分析H3K4me3在野生型(WT)和敲除菌株(ΔMrkmt2)中的染色质分布情况,发现KMT2介导的H3K4me3修饰主要与基因转录激活相关。通过对WT和突变体在体壁诱导条件下的ChIP-seq和RNA-seq的关联分析,结合遗传学验证和表型测定,发现受昆虫体壁诱导表达的KMT2通过将H3K4me3标记富集于转录因子Cre1基因位点染色质区域进而转录激活cre1的表达,上调表达的Cre1再通过转录激活疏水蛋白基因hyd4来调控真菌附着胞的分化形成,从而完整地揭示了由KMT2-Cre1-Hyd4协同调控附着胞发育分化的表观遗传学机制和调控通路(图1)。
该研究深入揭示了杀虫真菌附着胞分化的分子调控机制,不仅为虫生真菌与寄主昆虫相互作用提供新机制,而且为高效杀蚊真菌遗传改良提供新的靶点和改造策略。
中国科学院分子植物科学卓越创新中心副研究员赖屹玲和中国科学院上海营养与健康研究所博士后曹璇为该论文的共同第一作者,中国科学院分子植物科学卓越创新中心博士生陈晶晶、王历历参与了该项研究工作,王四宝研究员和魏刚研究员为共同通讯作者。该研究得到了国家重点研发计划重点专项、中国科学院战略性先导科技专项(B类)、国家自然科学基金、中国科学院重点部署项目等资助。
文章链接:https://advances.sciencemag.org/content/6/13/eaaz1659
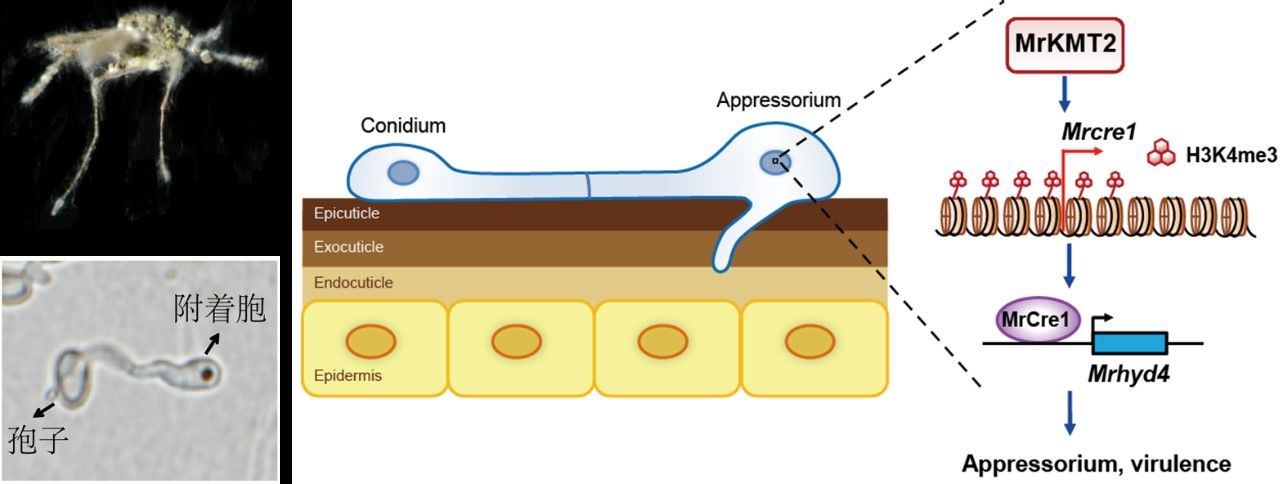
图1. 杀虫真菌通过表观遗传KMT2-Cre1-Hyd4通路调控侵染结构附着胞分化形成和杀蚊毒力的分子机制

中国菌物学会
| 我也说两句 |
| 版权声明: 1.依据《服务条款》,本网页发布的原创作品,版权归发布者(即注册用户)所有;本网页发布的转载作品,由发布者按照互联网精神进行分享,遵守相关法律法规,无商业获利行为,无版权纠纷。 2.本网页是第三方信息存储空间,阿酷公司是网络服务提供者,服务对象为注册用户。该项服务免费,阿酷公司不向注册用户收取任何费用。 名称:阿酷(北京)科技发展有限公司 联系人:李女士,QQ468780427 网络地址:www.arkoo.com 3.本网页参与各方的所有行为,完全遵守《信息网络传播权保护条例》。如有侵权行为,请权利人通知阿酷公司,阿酷公司将根据本条例第二十二条规定删除侵权作品。 |
 m.quanpro.cn
m.quanpro.cn